

Chemical bonding 是 Physical chemistry 类别下知识点最多,理解难度最 大的章节。其中关于物质物理性质,尤其以熔沸点的情况判断则是涉及了本章几乎所有要点。可以毫不夸张的讲,如果能够准确分析和比较不同类型物质的熔沸点,那么本章的重难点就被你拿捏的死死的了。
物质的熔沸点指的是物质在发生状态(固态,液态,气态)变化的时候所需的临界温度。因为从固态到液态,抑或从液态到气态,组成物质的微粒之间距离是增大的。在距离增大的过程需要克服微粒之间的吸引力。如果微粒间的吸引力越大,那么外界需要提供的能量也就越多,即我们认为的物质熔沸点越高。
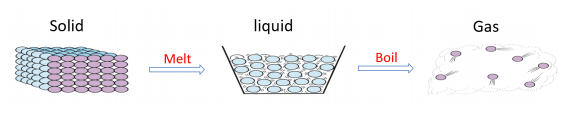
因此判断一个物质熔沸点的高低,就是要先确定组成该物质的微粒间吸引力类型,从而比较大小。在此之前,我们要对物质 bonding & structure 要有正确的认识和准确的判断。
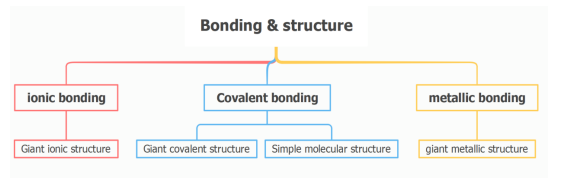
类型一
巨型结构物质和分子结构性物质的熔沸点比较
判断方法: 任意巨型(giant)结构物质的熔沸点取决于其相应的 bonding,分子性结构物质的熔沸点则取决于 intermolecular force。 已知任意 Bonding 远大于 intermolecular force,继而巨型结构性物质的熔沸点远高于分子结构性物质。
根据上述判断方法,我们通过真题实际演练一下。

首先,我们要判断 SiCl4 和 NaCl 的物质结构;SiCl4 由非金属元素组成,属于分子结构。NaCl 由金属 Na 和非金属 CL 元素构成,属于巨型离子结构。
其次分子结构性物质熔沸点由分子间作用力决定,而巨型离子结构性物质熔沸点由离子键决定;
最后因为离子键的强度远远大于分子间作用力,所以 NaCl 需要更多的能量(即外界提供更高的温度)去克服离子键,增大离子间距离,实现物质状态的变化。
参考答案:
NaCl is Giant ionic structure, it requires a lot of energy to overcome the strong ionic bond; However, the SiCL4 is simple molecular structure, and its intermolecular force is weak, which requires less energy to break.
类型二
巨型结构性物质的熔沸点比较
1) 巨型离子结构性物质(giant ionic structure)
判断方法:巨型离子结构性物质的熔沸点取决于阴阳离子间的静电吸引力大小(离子键强弱);阴阳离子的电荷越大,半径越小,静电吸引力越大,物质熔沸点越高。
2) 巨型金属结构性物质(giant metallic structure)
判断方法:巨型金属结构性物质的熔沸点取决于金属阳离子和离域电子间的静电吸引力大小(金属键强弱);金属阳离子的电荷越大,半径越小,静电吸引力越大,物质熔沸点越高。
类型三
分子性结构物质的熔沸点比较
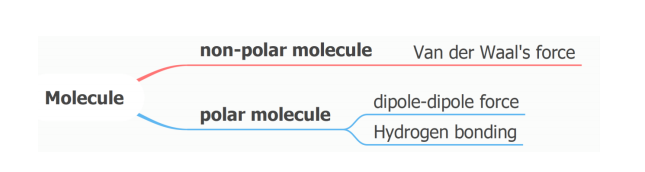
1) 非极性分子和非极性分子 (non-polar and non-polar molecule)
判断方法:非极性分子只存在 Van der Waal force,分子中的电子数量越多,Van der Waal force 越大。
2) 非极性分子和极性分子 (Non-polar and polar molecule)
判断方法:非极性分子只存在 Van der Waal force,而极性分子同时存在 Van der Waal force 和 dipole-dipole force。在两者 Van der Waal force 相同的情况下,非极性分子因为有额外的 dipole-dipole force,所以分子间作用力更大,熔沸点更高。
3) 极性分子和极性分子 (polar and polar molecule)
判断方法:Hydrogen bonding 一出,谁与“争锋”!!!如果是不存在 Hydrogen bonding的前提下,则有 Van der Waal force 决定分子间作用力的大小。根据上述分类和判断方法,我们通过真题实际演练一下。
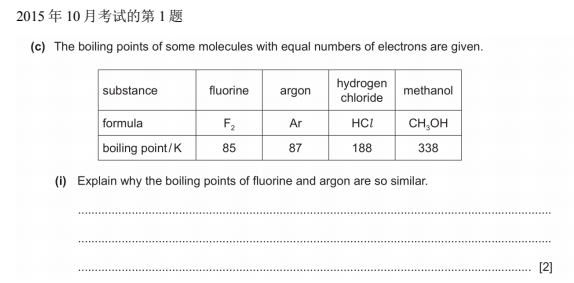
首先我们要判断 F2属于非极性分子,Ar 属于单原子气体。两者均只有 Van der Waal
force。因为电子数量相同,所以 Van der Waal force 相近,沸点相似。
参考答案:
F2 and Ar have similar strength of Van der Waal force owing to same number of electrons, so similar energy is required to overcome the force.

首先我们判断 HCL 属于极性分子,而 F2属于非极性分子。因为电子数相同,所以 Vander Waal force 相近。HCl 因为有额外的 dipole-dipole force,所以它的分子间作用力更大,沸点更高。
参考答案:
F2 is non-polar molecule and HCl is polar molecule, their van der Waal force is similar owing to same electron number. Therefore, HCl has stronger intermolecular force than F2。

首先我们判断 Methanol(CH3OH)是个属于极性分子。因为存在 hydrogen bonding,是最强的分子间作用力,所以沸点最 高。
参考答案:
Methanol has hydrogen bonding, which is the strongest intermolecular force.
综上所述,同学们在遇到物质熔沸点的问题时,可以根据上面的分类找到相应的解题思路,有的放矢。
预约A-Level辅导试听名额
唯有努力,不负时光,锦秋时光,相伴同行
新航道锦秋A-Level
湖北省A-level招生培训基地
新航道-用心用情用力做教育!
400-009-9696