
学科考试教学中心生化组——杨妍宁
A-Level化学的学习分为IG,AS和A2三个阶段,学完IG阶段后,大部分基础较好的同学会觉得IG段的学习较为简单,更加偏记背,理解和科普,从而在AS学习的时候就对AS的内容掉以轻心,直至考试时才发现成绩已经下滑了1-2个等级。IG,AS和A2这三个阶段中,AS起到了承前启后的作用,如果IG基础打得较为牢固,在AS上半学期的学习中不会感到很吃力,但如果AS下半学期有机内容掌握的不够扎实,那么在A2往后的学习中会觉得比较困难。因此,学好AS段的内容也尤为重要。



由此可见,AS涉及知识面包含了有机,无机,红外光谱图分析以及物质鉴别实验和现象等内容,章节数比A2要多,对同学们化学的综合素质有一定要求。且有机部分从第14-18章一共五个章节,基本上占据了下学期所有的学习时间,涉及到的有机物质种类,命名,反应类型和反应机理也比IG要更多更复杂,是整个AS阶段学习的重难点,且在选择和简答题考试占比中至少为1/3。
以冬季P1真题为例:
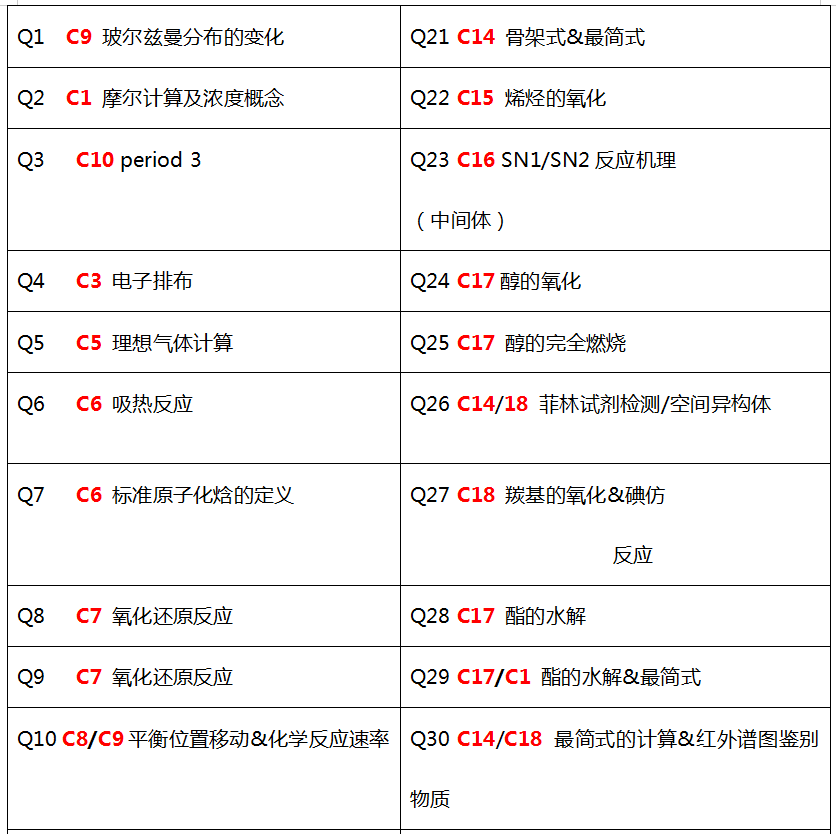
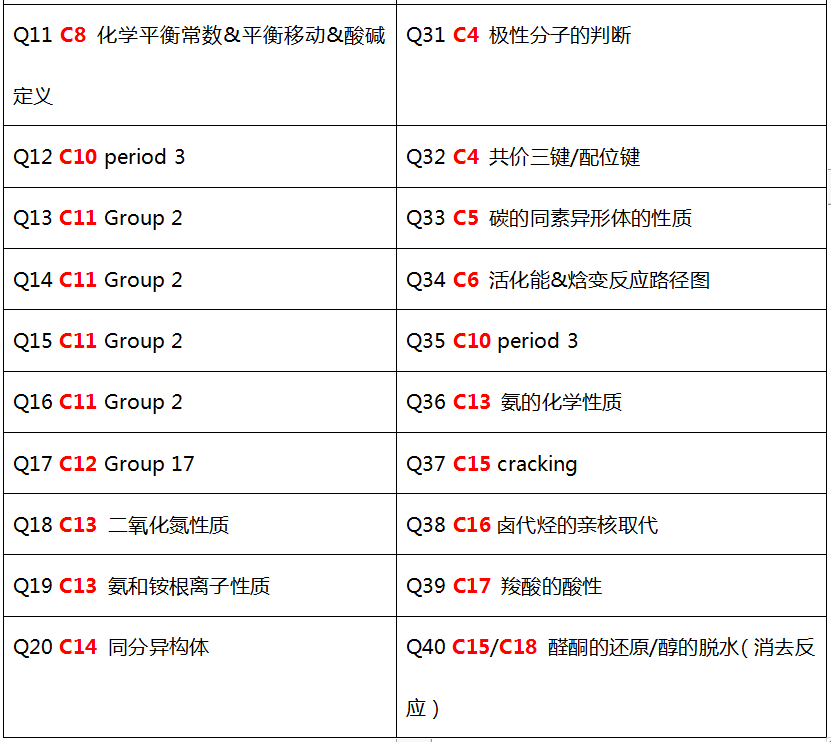
其中,无机部分(Chapter 1-13)占比为55%,有机部分(Chapter 14-18)占比为45%。由此可见有机部分的重要性,选择题分值占比已接近1/2。
各章节部分易错点及重难点:
C1:关于相对原子(分子)质量定义的表述;质谱仪的工作原理以及通过质谱图计算元素的相对原子质量(包括有机物质谱图的分析,利用M+1峰推断有机物分子中的碳原子个数,利用M+2峰推断溴原子或氯原子的存在);固体,溶液,气体(室温室压下)摩尔计算的公式和思路。
C2:原子的内部结构以及三种粒子自身的质量,特性;同位素的定义和表示方式;
C3:能级,亚能级和原子轨道之间的关系以及原子轨道的数目和形状;电子排布的准则和规律(牢记Cr和Cu两个特例);电子排布式的书写;影响第一电离能的因素,第一电离能周期性的变化以及对应的解释;能通过连续电离能的表格或图片推断原子最外层电子数。
C4:离子键共价键形成的原因和本质;离子化合物,共价化合物点差图的画法和对应的物理性质;σ键和π键的形成以及中心原子杂化类型的判断;配位键的形成原因和例子;金属的微观结构和对应的物理性质;电负性,极性的含义,能判断共价键以及分子的极性;能判断三种分子间作用力的类型和三种力的大小关系,熟悉氢键对水的物理性质的影响;能根据电子对互斥理论和成键电子对以及孤电子对的对数判断分子在空间中的构型(包括常见的有机分子构型和一些特例,例如:BF3,PF5,SF6)。
C5:理想气体的三大假设和理想气体方程的运用和计算;能判断不同物质微观结构的类型;熟悉碳的同素异形体(钻石,石墨,石墨烯,C60,纳米管)的不同结构。
C6:吸热,放热反应的能量变化图和典型例子;不同种类焓变定义的表述(生成焓,燃烧焓,中和焓);盖斯定律的运用和计算;能通过键能或生成焓计算反应焓,和通过燃烧焓计算生成焓。
C7: 化还原和电子转移以及化合价的关系;能准确判断被氧化的是还原剂,被还原的是氧化剂;能通过方程式左右两边电荷数守恒,原子个数守恒以及氧化还原反应中得失电子数守恒进行配平。
C8: 平衡特征的描述和前提条件;能利用勒夏特列原则判断平衡位置的移动;能通过I.C.E方法计算平衡常数的值;Brønsted – Lowry酸碱的定义以及共轭酸碱对的判断;滴定曲线的绘制。
C9:熟悉玻尔兹曼分布图的画法和随温度上升/下降的改变;催化剂的定义和工作原理;温度,压强,浓度,表面积对反应速率的影响和对应的解释。
C10:原子/离子半径,熔点,导电性,第一电离能的周期性;第三周期元素与氧气/氯气的反应;第三周期元素氧化物和氯化物的性质,结构以及和水的反应(包括反应方程式的书写)。
C11:第二主族元素及其氧化物的物化性质(包括氧化物和水的反应);第二主族硫酸盐/氢氧化物溶解度的趋势;碳酸盐/硝酸盐热稳定性的趋势。
C12:第七主族元素的物化性质(置换反应);卤化氢的热稳定性;卤素离子的检测;相似相溶原理;卤素离子和浓硫酸的反应(方程式及其现象);歧化反应;卤素及其化合物的实际用途。
C13:氮的氧化物的生成;氨气的检测;造成的环境问题(包括二氧化硫和二氧化氮的反应)
C14:区分四种表达式,掌握有机物命名法则;会判断同分异构体的数目和类型,包括造成同分异构的原因和必备条件;大致了解有机反应机理的类型(包括均裂和异裂的定义和表示方式)
C15:烷烃取代反应自由基机理三个大步骤所对应的反应方程式;烯烃和氢气/卤素/卤化氢/水蒸气发生加成反应的条件和机理图的画法;能通过碳正离子稳定性解释加成主产物生成的原因;烯烃在不同条件下的氧化产物;能通过加聚聚合物的一部分推断出重复单元和对应的单体。
C16:卤代烃亲核取代的机理图画法(SN1和SN2分别针对三级和一级卤代烃);卤代烃发生不同取代时的产物和对应的反应条件;卤代烃发生消去反应的产物和条件,尤其要注意溶剂的选择;卤代烃的水解反应和实际用途。
C17: 醇的燃烧/取代/酯化/脱水/氧化/和金属钠反应的方程式及其反应条件;腈能在酸性条件下水解成羧酸;羧酸的还原反应和所用的还原剂(LiAlH4);酸性重铬酸钾/酸性高锰酸钾作为氧化剂的区别。
C18:醛的制备需要及时蒸馏;醛和酮还原的反应方程式和机理图要非常熟悉;能区分还原剂四氢锂铝和硼氢化钠;熟悉醛酮和HCN亲核加成的机理图画法;醛酮鉴别的原理和现象(Fehling’s solution和Tollens’ reagent);鉴别甲基酮(H3CH(OH)- group)的试剂,原理和现象;熟悉红外光谱图中常见官能团特征峰的形状和波数。